Étude DELIGHT
Glycolysis Changes in Alloreactive Memory B Cells in Highly Sensitized Kidney Transplant Recipients Undergoing Desensitization Therapy
ARTICLE PUBLIÉ DANS LA REVUE TRANSPLANT INTERNATIONAL
le 8 juillet 2024
projet d’étude “delight”
état des lieux au 27/02/2023
état des lieux au 29/09/2023
état des lieux au 5/05/2024
publication de l’étude “delight”
Modifications de la glycolyse
dans les cellules B mémoires alloréactives chez les receveurs de greffes de rein
hyper sensibilisés et soumis à une thérapie de désensibilisation
Johan Noble 1,2,3, Lara Cabezas 1,2, Aurelia Truffot 3,4, Lucile Dumolard 2, Thomas Jouve 1,2, Paolo Malvezzi 1, Lionel Rostaing 1,2, Céline Dard 5, Philippe Saas 2,5, Paolo Cravedi 3 and Zuzana Macek-Jilkova 2,6
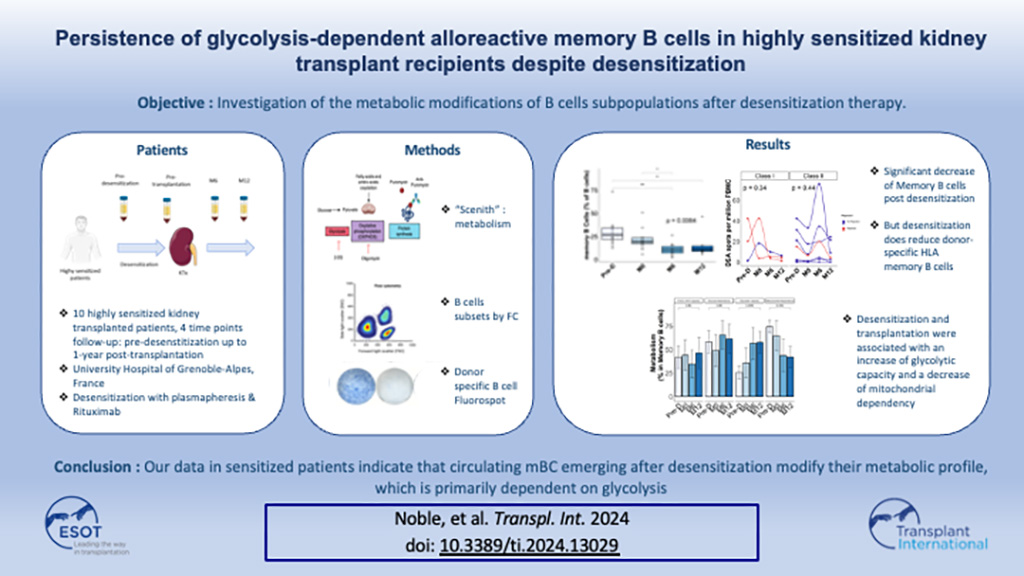
Résumé
Malgré l’utilisation croissante des stratégies de désimmunisation, les patients hyperimmunisés restent à haut risque de rejet médié par les anticorps, ce qui suggère que, même lorsque les anticorps spécifiques au donneur (DSA) sont effectivement enlevés, les lymphocytes B spécifiques du donneur persistent. Nous avons inclus 10 receveurs hyperiummunisés ayant subi une désimmunisation par plasmaphérèse et déplétion des lymphocytes B avant une transplantation rénale.
Nous avons quantifié les changements dans les DSA (Luminex), les sous-populations totales de lymphocytes B (cytométrie en flux), les lymphocytes B spécifiques de l’HLA du donneur (Fluorospot), et le métabolisme à l’échelle cellulaire dans des échantillons collectés avant la désimmunisarion au moment de la transplantation, et à 6 et 12 mois post transplantation.
La désimmunisation a été associée à une diminution des DSA et du pourcentage de lymphocytes B mémoires et naïfs totaux, tandis que les plasmocytes et les lymphocytes B mémoires circulants spécifiques de l’HLA du donneur persistaient jusqu’à 12 mois après la transplantation. À 12 mois après la transplantation, les lymphocytes B mémoires ont augmenté leur capacité glycolytique, tandis que les plasmocytes prolifératifs KI67+ ont modifié leur métabolisme en augmentant leur capacité d’oxydation des acides gras et des acides aminés et en diminuant leur dépendance au glucose.
Malgré une déplétion efficace des DSA, les lymphocytes B spécifiques du donneur persistent chez les receveurs de greffe rénale. En raison de la dépendance de ces cellules à la glycolyse, les thérapies ciblant la glycolyse pourraient représenter une stratégie de traitement innovante.
Mots clefs: désensibilisation; anticorps spécifique du donneur; glycolyse; transplantation rénale; cellules B de la mémoire; métabolisme.
Affiliations
- Service de néphrologie, d’hémodialyse-aphérèse et de transplantation rénale, CHU Grenoble Alpes, Grenoble, France,
- Université Grenoble Alpes, CNRS, lnserm, CHU Grenoble Alpes, lnstitut des Biosciences Avancées, Grenoble, France,
- Département de médecine, Centre de recherche translationnelle sur la transplantation, lcahn School of Medicine at Mount Sinai, New York, NY, États-Unis,
- Service de virologie, Hôpital universitaire de Grenoble, Grenoble, France,
- EFS, Recherche et Développement, Grenoble, France, Service d’hépato-gastroentérologie et d’oncologie digestive, CHU Grenoble Alpes, Grenoble, France
ARTICLE DANS SON INTÉGRALITÉ
le 8 juillet 2024
Notre étude identifie des changements métaboliques dans les cellules B après la transplantation, mettant en évidence la glycolyse comme une cible potentielle pour prévenir le rejet à médiation d’anticorps chez les receveurs de greffes de rein.
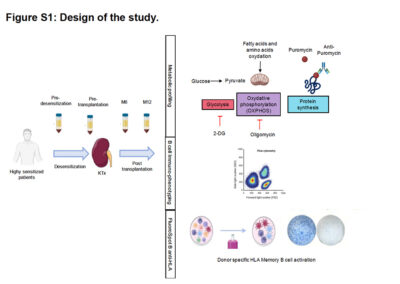
Figure S1: Design of the study
Des cellules mononucléaires périphériques (PBMC) ont été prélevées chez des patients hautement sensibilisés subissant une désensibilisation en vue d’une transplantation rénale. Les PBMC ont été prélevées avant la désensibilisation (Pre-D), avant la transplantation (M0), au mois 6 (M6) après la transplantation et au mois 12 (M12) après la transplantation. Simultanément, les PBMC ont été utilisées pour analyser les sous-populations de cellules B par immuno-phénotypage, profilage métabolique par la méthode SCENITH et HLA B cell FluoroSpot.
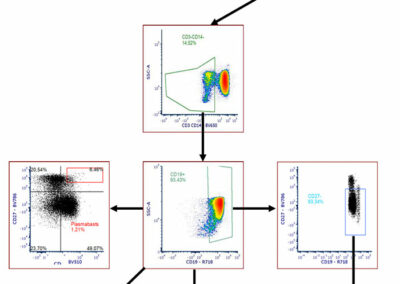
Figure S2: Gating strategy of B cells.
Mononuclear cells were gated out of all events followed by single cell gating and live cells. We then used a dumped channel to exclude T lymphocytes (CD3+) and most of monocytes (CD14+) to improve our sensitivity. B cells were then gated as CD19+ cells. Finally, B cells were subdivided into plasma cells (CD38hiCD27hi), naive B cells (IgD+CD27-), memory B cells (CD27+) and transitional B cells (CD27-CD24hiCD38hi).
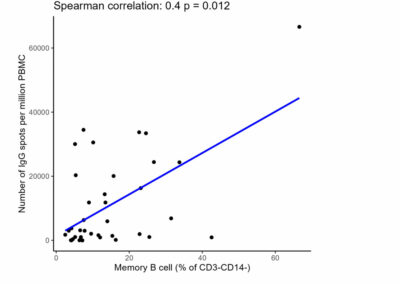
Figure S3: Correlation between total IgG spots secreted by polyclonal antibody secreting cells by FluoroSpot and percentage of memory B cells
Memory B cells are gated CD27+ within CD3- and CD14- lymphocytes. Memory B cell differentiation into plasma cells assessed by FluoroSpot measuring total IgG spots secreted by polyclonal antibody secreting cells and expressed as mean number of spots per million of PBMC. All analysis times were included, i.e. pre-desensitization, pre-transplantation, M6 and M12 post-transplantation.
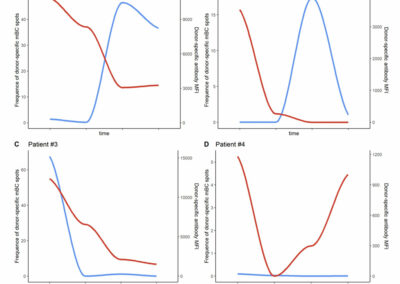
Figure S4: Correlation between antigen specific DSA and memory B cell by FluoroSpot
Donor-specific Memory B cell (mBC) differentiation into plasma cells are assessed by Fluorospot (blue line). Donor-specific Antibody (DSA) of the same HLA antigen are quantified using Luminex assay (red line). Patient #1 and Patient #3 experienced acute antibody-mediated rejection in the follow-up of transplantation. Three patients has a similar pattern as patient #3 (i.e. decreasing of DSA and specific mBC without any rebound) and 3 similar du patient #2 (i.e. rebound of specific mBC without the rebound of DSA). Patient #1 showed an important increase of specific mBC associated with a less efficient decrease of DSA post transplantation, MFI > 3000).
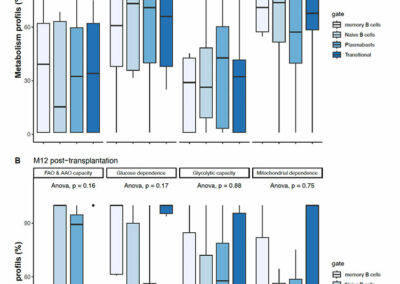
Figure S5: Metabolic profile of B cells at baseline and at 12-months.
Boxplots of metabolism profile (%) in each B cells subtypes before desensitization (Pre-D), and at month-12 (M12) post-transplantation. *P < .05 by Anova test. FAO: fatty acids oxidation; AAO: amino acids oxidation.
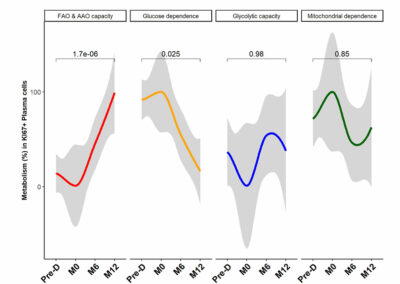
Figure S6: Desensitization and transplantation impact on KI67+ plasma cells.
Trends in KI67+ plasma cells metabolism profile evolution before desensitization (Pre-D), pre-transplantation (M0), at month-6 (M6) and at month-12 (M12) post-transplantation. The P value is indicated the evolution of metabolism percentage between Pre-D and M12. *P < .05 by Wilcoxon test. FAO: fatty acids oxidation; AAO: amino acids oxidation.